Sujets : Sécurité publique, CFG
Avis - Des produits de santé non homologués saisis au Tokyo Beauty and Healthcare à Richmond (Colombie-Britannique) peuvent présenter de graves risques pour la santé
OTTAWA, ON, le 8 mars 2024 /CNW/ - MISE À JOUR : le 8 mars 2024 : Des produits de santé non homologués additionnels ont été saisis dans un autre magasin Tokyo Beauty and Healthcare à Richmond, en Colombie-Britannique.
Pour faire suite à sa communication du 18 septembre 2023, Santé Canada avise les consommateurs de la saisie de produits de santé non homologués additionnels dans un autre magasin Tokyo Beauty and Healthcare, situé au 4151 Hazelbridge Way, unité 3660, à Richmond, en Colombie-Britannique. Les étiquettes de ces produits indiquent la présence de médicaments d'ordonnance, contrôlés ou en vente libre qui peuvent poser de graves risques pour la santé.
Les produits saisis ont été ajoutés au tableau des produits visés ci-dessous. Vous trouverez également plus loin de l'information sur les risques pour la santé associés à ces médicaments ainsi que des renseignements à l'intention des consommateurs.
Avis original : Le 18 septembre 2023 : Des produits de santé non homologués saisis dans un magasin Tokyo Beauty and Healthcare à Richmond, en Colombie-Britannique, peuvent présenter de graves risques pour la santé
- Produit : Produits de santé non homologués dont l'étiquette indique qu'ils contiennent des médicaments contrôlés ou d'ordonnance
- Problème : Produits de santé - Sécurité des produits
- Ce qu'il faut faire : N'utilisez pas ces produits. Achetez vos médicaments d'ordonnance uniquement dans des pharmacies autorisées. Apportez les produits à votre pharmacie locale pour qu'ils soient éliminés de façon adéquate. Consultez un professionnel de la santé si vous avez utilisé l'un de ces produits et que vous avez des préoccupations quant à votre santé. L'un des produits (Pabron Gold A Granules Cold Medication) contient un opioïde. Si vous soupçonnez une surdose d'opioïdes, composez le 911 et administrez de la naloxone si vous en avez à votre disposition.
Santé Canada met les consommateurs en garde contre des produits de santé non homologués qu'il a saisis dans un magasin Tokyo Beauty and Healthcare à Richmond (Colombie-Britannique) (120 - 8191 Westminster Highway). L'étiquette de ces produits indique la présence de médicaments contrôlés ou d'ordonnance qui peuvent poser de graves risques pour la santé.
La vente de produits de santé non homologués au Canada est illégale. Les produits de santé non homologués n'ont pas été autorisés par Santé Canada, ce qui signifie que leur innocuité, leur efficacité et leur qualité n'ont pas été évaluées et qu'ils peuvent présenter de graves risques pour la santé. À titre d'exemple, ils peuvent contenir des ingrédients à risque élevé (comme des médicaments d'ordonnance, des additifs ou des contaminants) dont la présence pourrait ne pas être indiquée sur l'étiquette. Ces ingrédients pourraient interagir avec d'autres médicaments et aliments. De plus, ces produits pourraient ne pas vraiment contenir les ingrédients actifs auxquels les consommateurs s'attendent pour aider au maintien ou à l'amélioration de leur santé.
Les médicaments d'ordonnance ne doivent être utilisés que sous la supervision d'un professionnel de la santé, car ils sont utilisés pour traiter des problèmes de santé précis et peuvent causer des effets secondaires graves. Les médicaments d'ordonnance ne peuvent être vendus légalement aux consommateurs canadiens qu'avec une ordonnance.
Produit | Usage prévu | Médicament contrôlé/d'ordonnance mentionné sur l'étiquette | Magasin Tokyo Beauty and Healthcare |
Pabron Gold A Granules Cold Medication | Soulagement des symptômes du rhume | Présence de phosphate de dihydrocodéine indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Kobayashi Pharmaceutical Iron + Folic Acid + Vitamin B12 Blood Supplement Tablets | Amélioration de la production d'hémoglobine sanguine et de l'anémie | Présence d'acide folique d'ordonnance indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Mentholatum Mediquick Eczema Rash Anti-Itch Cream | Soulagement de l'eczéma et des éruptions cutanées | Présence d'acétate de valérate de prednisolone indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Mentholatum Mediquick Ointment | Soulagement de l'eczéma et des éruptions cutanées | Présence d'acétate de valérate de prednisolone indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Nichiban Speel Ko | Élimination des verrues, des cors et des callosités | Présence d'acide salicylique d'ordonnance indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Ohta's Isan A | Amélioration de la digestion et soulagement des brûlures d'estomac | Présence d'acide ursodésoxycholique indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Santen Beauteye Contact | Fatigue oculaire | Présence de méthylsulfate de néostigmine indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Santen PC Eyedrops | Fatigue oculaire et inflammation des yeux | Présence de méthylsulfate de néostigmine indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Smile 40EX Gold Cool MAX | Fatigue oculaire et vision trouble | Présence de méthylsulfate de néostigmine indiquée sur l'étiquette | 120-8191 Westminster Highway, Richmond (C.-B.) |
Santen Sante Beauteye Moon Care | Prévention des maladies oculaires, de la congestion conjonctivale, des yeux troubles | Présence d'acide aminocaproïque indiquée sur l'étiquette | 4151 Hazelbridge Way, unité 3660, Richmond (C.-B) |
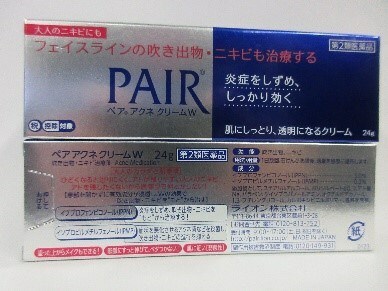
Pair Acne Cream | Traitement de l'acné | Présence de piconol d'ibuprofène 3 % indiquée sur l'étiquette | 4151 Hazelbridge Way, unité 3660, Richmond (C.-B) |
Pabron Gold A Granules Cold Medication | Soulagement des symptômes du rhume | Présence de phosphate de dihydrocodéine indiquée sur l'étiquette | 4151 Hazelbridge Way, unité 3660, Richmond (C.-B) |
Mentholatum Mediquick Eczema Rash Anti-Itch Ointment | Soulagement de l'eczéma et des éruptions cutanées | Présence d'acétate de valérate de prednisolone indiquée sur l'étiquette | 4151 Hazelbridge Way, unité 3660, Richmond (C.-B) |
Hadalabo Pearl Barley Face Wash | Traitement de la peau | Présence d'acide aminocaproïque indiquée sur l'étiquette | 4151 Hazelbridge Way, unité 3660, Richmond (C.-B) |
- N'utilisez pas ces produits. Apportez les produits à votre pharmacie locale pour qu'ils soient éliminés de façon adéquate.
- Consultez un professionnel de la santé si vous avez utilisé l'un de ces produits et que vous avez des préoccupations quant à votre santé.
- Le produit Pabron Gold A Granules Cold Medication contient un opioïde. Une surdose d'opioïdes est une urgence médicale qui pourrait entraîner la mort si elle n'est pas traitée. Si vous soupçonnez une surdose d'opioïdes, composez le 911 et administrez de la naloxone si vous en avez à votre disposition.
- Achetez vos médicaments d'ordonnance uniquement dans des pharmacies autorisées.
- Lisez l'étiquette des produits de santé pour vérifier si Santé Canada en a autorisé la vente. Les produits de santé homologués portent un numéro de produit naturel (NPN), un numéro de médicament homéopathique (DIN-HM) ou un numéro d'identification du médicament (DIN) à huit chiffres. Vous pouvez également vérifier si la vente des produits a été autorisée en consultant la Base de données sur les produits pharmaceutiques et la Base de données sur les produits de santé naturels homologués de Santé Canada.
- Signalez à Santé Canada tout effet secondaire ou toute plainte concernant un produit de santé.
L'acide aminocaproïque est un ingrédient médicamenteux d'ordonnance utilisé pour réduire les saignements dans diverses situations cliniques. L'exposition de l'oeil à l'acide aminocaproïque peut affecter l'oeil lui-même, et l'acide peut être absorbé par le sang à travers les canaux lacrymaux. Les effets secondaires peuvent inclure des yeux larmoyants, des changements de la vision, des maux de tête, des étourdissements, des nausées, une faiblesse musculaire et des éruptions cutanées.
Le phosphate de dihydrocodéine est une substance contrôlée visée par la Loi réglementant certaines drogues et autres substances et est semblable à la codéine opioïde. La codéine est approuvée au Canada, mais Santé Canada n'a autorisé aucun produit pharmaceutique contenant de la dihydrocodéine. Les comprimés de dihydrocodéine sont autorisés dans certains pays pour le soulagement de douleurs chroniques graves ou comme antitussifs. Les effets indésirables les plus fréquents sont les étourdissements, les maux de tête, les vertiges, les troubles de la vue, la confusion, l'euphorie, les nausées et la constipation. Comme pour tous les opioïdes, l'utilisation de dihydrocodéine peut entraîner une dépendance. La dihydrocodéine peut ralentir ou arrêter la respiration, ce qui peut entraîner une somnolence grave, une perte de conscience et la mort (surdose d'opioïdes). Les personnes qui ont d'autres problèmes de santé, notamment des affections qui touchent les poumons, le foie ou les reins, peuvent présenter un risque plus élevé de surdose. En outre, les enfants sont plus susceptibles de faire une surdose en raison de leur petite taille. La dihydrocodéine ne doit pas être utilisée par les personnes enceintes ou qui allaitent, ni par les personnes qui y sont allergiques. L'utilisation de dihydrocodéine avec d'autres dépresseurs du système nerveux central (alcool, somnifères, etc.) peut aggraver ses effets. En cas de surdose, la naloxone peut temporairement inverser les effets de la dihydrocodéine.
Les comprimés d'acide folique à des concentrations supérieures à 1 mg sont des médicaments d'ordonnance vendus au Canada pour la prévention et le traitement des carences en folates, des malformations congénitales et des effets secondaires liés au traitement par le méthotrexate. L'acide folique ne doit pas être pris à des doses supérieures à 1 mg par jour sans l'avis d'un professionnel de la santé. Le fait de prendre trop d'acide folique peut masquer les signes d'une carence en vitamine B12 et augmenter le risque de lésions neurologiques progressives et non reconnues. Le fait de prendre trop d'acide folique peut aussi accroître le risque de cancer colorectal et possiblement d'autres cancers chez certaines personnes. De fortes doses d'acide folique peuvent entraîner des symptômes, notamment une perte d'appétit, des nausées, des ballonnements abdominaux, des gaz, un goût amer, des changements relativement au sommeil, des problèmes de concentration, une dépression, une altération du jugement, ainsi qu'une sensation d'irritabilité, d'excitation, d'hyperactivité ou de confusion. Les effets secondaires rares mais graves comprennent des réactions allergiques graves. L'acide folique ne doit pas être pris par les personnes qui ont une carence en vitamine B12 non traitée. L'acide folique oral ne doit pas être pris par les personnes atteintes de maladies de l'intestin grêle, en particulier la maladie de Crohn et la maladie coeliaque, en raison des difficultés d'absorption de l'acide folique.
Le piconol d'ibuprofène 3 % est un médicament topique (appliqué sur la peau) anti-inflammatoire non stéroïdien (AINS) utilisé pour le soulagement des brûlures. Santé Canada n'a approuvé aucun médicament contenant de l'ibuprofène pour une application topique. L'ibuprofène absorbé par la peau peut causer des effets secondaires partout dans le corps, surtout lorsqu'il est appliqué sur une grande surface et pour une longue période, ou sur une peau endommagée. L'ibuprofène topique peut engendrer de sérieux effets secondaires chez les personnes qui sont allergiques à l'ibuprofène, à l'aspirine ou aux autres AINS, ou qui sont asthmatiques. L'utilisation de l'ibuprofène topique peut aussi causer de sérieux effets secondaires, tels que des hémorragies de l'estomac et des intestins, des dysfonctionnements ou des insuffisances rénaux, ou encore des dysfonctionnements ou des défaillances cardiovasculaires chez les personnes qui ont des problèmes avec ces organes. L'ibuprofène topique peut aussi causer de sérieux effets secondaires chez les personnes enceintes ou qui allaitent, tels que des accouchements retardés ou de plus longue durée.
Le méthylsulfate de néostigmine est un médicament d'ordonnance vendu au Canada sous forme d'injection servant à prévenir et à traiter la rétention d'urine et les complications intestinales après une intervention chirurgicale; à inverser l'effet paralysant de certains médicaments utilisés en chirurgie et en sismothérapie; et à contrôler les symptômes de la myasthénie grave (une maladie qui provoque une faiblesse des muscles squelettiques). Son utilisation sous forme de gouttes oculaires n'a pas été approuvée au Canada. Par le passé, des médicaments semblables à la néostigmine étaient utilisés pour traiter le glaucome, un groupe d'affections oculaires habituellement caractérisées par une pression élevée à l'intérieur de l'oeil. Ces médicaments ne sont plus utilisés à grande échelle en raison du nombre important d'effets secondaires possibles liés aux yeux, notamment une vision éloignée trouble, des maux de tête frontaux, des spasmes des paupières, des yeux rouges, des cataractes (embrouillement du cristallin de l'oeil, lequel est normalement transparent), des réactions allergiques, des kystes de l'iris, un décollement de la rétine avec une acuité visuelle réduite, l'apparition soudaine de points lumineux ou de corps flottants pouvant entraîner une perte de vision permanente, et la probabilité d'une crise de glaucome d'un type particulier, avec une possible perte de vision permanente. Ils peuvent en outre entraîner de graves effets secondaires cardiaques ou respiratoires s'ils sont absorbés dans le nez en passant par les conduits lacrymaux.
L'acétate de valérate de prednisolone est un corticostéroïde d'ordonnance offert au Canada sous forme de gouttes oculaires utilisées pour traiter l'inflammation de plusieurs parties de l'oeil. Son utilisation dans les crèmes ou les onguents n'a pas été approuvée au Canada. Parmi les effets secondaires courants des corticostéroïdes topiques, mentionnons l'atrophie de la peau (peau mince et fragile avec réduction de l'élasticité), les changements des vaisseaux sanguins de la peau (p. ex. télangiectasie en araignée), les changements de la couleur de la peau, les vergetures, l'enflure, la peau sèche, la sensation de brûlure, l'irritation locale, les éruptions cutanées, les rougeurs, les démangeaisons, l'amincissement des cheveux ou la croissance excessive des cheveux, les infections et les réactions allergiques. Les corticostéroïdes topiques absorbés par la peau peuvent causer des effets secondaires dans tout le corps, surtout lorsqu'ils sont utilisés sur une grande surface et pendant longtemps. Ce risque est plus élevé chez les enfants, qui peuvent absorber des quantités proportionnellement plus importantes et être plus sensibles aux effets secondaires. Les effets secondaires systémiques peuvent comprendre l'hypertension artérielle, l'hyperglycémie, une vision trouble, des battements cardiaques inégaux, de la faiblesse et de l'enflure. L'acétate de valérate de prednisolone ne doit pas être utilisé par des personnes allergiques à l'acétate de prednisolone ou à tout ingrédient de la préparation. L'acétate de valérate de prednisolone ne doit pas être utilisé chez les enfants et son utilisation n'est pas recommandée pendant la grossesse ou l'allaitement.
L'acide salicylique est un médicament d'ordonnance lorsqu'il est vendu pour un usage topique et que sa concentration dépasse 20 % ou qu'il a un certain niveau d'acidité (pH inférieur à 3,0), sauf si le produit est vendu pour être appliqué sur des verrues, des cors ou des callosités. L'acide salicylique sert également à traiter l'acné. Il est déconseillé aux personnes qui y sont allergiques, aux personnes atteintes de diabète, aux personnes qui ont une mauvaise circulation ou une perte de sensibilité dans les extrémités (mains et pieds), ainsi qu'aux enfants et aux adolescents atteints de la grippe ou de la varicelle (car il peut augmenter le risque de syndrome de Reye, une maladie grave qui peut entraîner des convulsions et le coma). Il est à proscrire chez les personnes enceintes ou qui allaitent, sauf si la surface exposée et la durée du traitement sont limitées. Certains produits contenant de l'acide salicylique ne devraient pas être utilisés par des enfants de moins de deux ans. L'acide salicylique peut provoquer de graves réactions allergiques (urticaire, démangeaisons, difficulté à respirer et enflure du visage, des lèvres ou de la langue) et une irritation cutanée intense (rougeur, sensation de brûlure, sécheresse, démangeaisons et desquamation). Il peut également entraîner une intoxication salicylée, soit une affection grave qui se manifeste par des nausées, des vomissements, des étourdissements, une perte auditive, un bourdonnement dans les oreilles, de la diarrhée, de la confusion, une respiration rapide et de la somnolence. Des effets secondaires sont plus susceptibles de se produire chez les enfants, chez les personnes atteintes d'une maladie du foie ou du rein et dans le cas d'une utilisation prolongée sur une grande surface du corps. Il ne faut pas appliquer d'acide salicylique sur des lésions infectées, des grains de beauté, des taches de naissance, des verrues avec des poils ou des verrues sur le visage.
L'acide ursodésoxycholique est un médicament d'ordonnance utilisé dans le traitement des maladies hépatiques cholestatiques (maladies qui entraînent un blocage ou une réduction du flux biliaire). Les effets secondaires graves de l'acide ursodésoxycholique comprennent des réactions allergiques, des douleurs thoraciques, des difficultés à respirer, des maux d'estomac, des nausées, de la diarrhée ou de la constipation, un gonflement des extrémités (mains et pieds), de l'hypertension artérielle, de la fatigue, des étourdissements, des maux de tête, des démangeaisons, de la fièvre et une jaunisse. Certains patients présentent d'autres symptômes comme des vomissements et des douleurs dans la région abdominale en raison de blocages dans le tractus gastro-intestinal, ce qui nécessite une intervention médicale. Des analyses sanguines sont nécessaires pour surveiller le risque de toxicité hépatique lié à la prise de ce médicament. L'acide ursodésoxycholique ne doit pas être pris par les personnes qui sont allergiques à l'ursodiol, qui ont un blocage du flux biliaire dû à une maladie du foie ou à une autre affection, ni par les personnes qui sont enceintes, qui prévoient devenir enceintes ou qui allaitent.
Also available in English
SOURCE Santé Canada (SC)
Ces communiqués peuvent vous intéresser aussi
|
Communiqué envoyé le et diffusé par :