Sujet : FVT
Hanmi Pharmaceutical attend l'approbation de la FDA pour 2 nouveaux médicaments
- L'approbation BLA/NDA de Rolontis et d'Oraxol par la FDA est attendue dans le courant de cette année
- LAPSTriple Agonist, un nouveau médicament innovant à triple action pour le traitement de la NASH, en extension d'indication
- L'efpéglénatide a atteint le principal objectif de la phase 3
- Chercher à atteindre le développement de maladies rares comme avec un médicament à prendre une fois par mois pour le syndrome de l'intestin court
SEOUL, Corée du Sud, 18 janvier 2021 /PRNewswire/ -- Hanmi Pharmaceutical Co., Ltd. prévoit de créer une réussite R&D mondiale basée sur des innovations de traitement de l'inflammation et de la fibrose, un nouveau médicament à triple action pour le traitement de la NASH (stéatohépatite non alcoolique), ainsi que diverses autres innovations dans les domaines des maladies métaboliques, de l'oncologie et des maladies rares.

- Quelle sera la stratégie de Hanmi en 2021 en matière de R&D sur les nouveaux médicaments
En particulier, deux nouveaux médicaments développés par Hanmi Pharmaceutical Co., Ltd. devraient être approuvés par la FDA américaine cette année. « Rolontis », un traitement contre la neutropénie, dont la technologie a été cédée sous licence à Spectrum Pharmaceuticals, Inc., et « Oraxol », qui a été cédé sous licence à Athenex, Inc. pour le traitement du cancer du sein métastatique, en cours d'examen prioritaire par la FDA, sont sur le point d'annoncer les résultats de leur approbation BLA/NDA (demande de licence biologique, BLA), respectivement.
« Les capacités de R&D de Hanmi Pharmaceutical Co., Ltd. et la forte confiance entre les multiples partenaires restent solides », a déclaré le Dr Kwon, en soulignant que « les deux nouveaux médicaments seront approuvés par la FDA dans un avenir proche, et l'attente des projets en cours de Hanmi cette année est plus grande que jamais. »
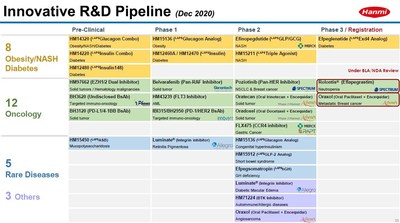
- L'extension de l'indication pour le LAPSTriple Agonist (HM15211) est annoncée
LAPSTriple Agonist (HM15211), un triple agoniste, a démontré un effet de réduction de la graisse hépatique de 50 % ou plus lors des récents essais cliniques aux États-Unis. Il est en cours de développement pour devenir le traitement NASH le plus efficace au niveau mondial. L'effet de réduction du foie gras en 12 semaines a atteint 80 % par rapport au groupe témoin placebo, et l'effet de réduction des enzymes hépatiques a également été statistiquement important.
Sur cette base, une étude clinique mondiale de phase 2 pour le LAPSTriple Agonist est actuellement en cours, et elle a reçu la désignation Fast Track de la FDA pour accélérer le développement du médicament pour la NASH.
La FDA a également désigné le LAPSTriple Agonist (HM15211) comme médicament orphelin pour le traitement de la cholangite sclérosante primaire (CSP) et de la cholangite biliaire primaire (CBP) en 2020, et les indications seront élargies pour inclure également la fibrose pulmonaire idiopathique (FPI) et la bronchopneumopathie chronique obstructive (BPCO).
Une étude clinique de phase 3 (Amplitude-M) sur l'efpéglénatide, qui est développé comme traitement du diabète, a récemment été achevée et a atteint le critère d'évaluation principal en obtenant une « réduction de 30 semaines de l'hémoglobine glyquée (HbA1c) par rapport à celle du placebo » dans les cohortes de dose. L'étude a également confirmé son effet de perte de poids, qui était un critère d'évaluation secondaire. Hanmi Pharmaceutical Co., Ltd. prévoit de maximiser les effets du traitement en combinant l'efpéglénatide avec un autre nouveau médicament tel que le LAPSGlucagon Analog(HM15136).
En outre, le LAPSGLP/GCG (éfinopegdutide), dont la licence a été accordée à MSD l'année dernière, est entré en essai clinique de phase 2 cette année, et le développement en tant que traitement NASH sera accéléré.
- Être leader dans le domaine de l'oncologie grâce à l'innovation ouverte
Hanmi Pharmaceutical Co., Ltd. a également mis l'accent sur des plans de développement intensifs en immuno-oncologie, inflammation et fibrose, sur de nouvelles plates-formes, et sur les maladies rares grâce à l'innovation ouverte.
Le Poziotinib, qui a réussi l'année dernière des essais cliniques sur des patients atteints de carcinome non à petites cellules (NSCLC) avec mutation HER2, devrait être soumis à l'approbation de la FDA américaine cette année. Belvarafenib (HM95573, tumeur solide), dont la licence a été accordée à Genentech, Inc. est sur le point d'entrer dans une étude clinique mondiale, et une étude clinique d'augmentation et d'expansion de la dose du double inhibiteur FLT3/SYK (HM43239), qui a démontré une rémission complète chez les patients atteints de leucémie myéloïde aiguë (LMA) avec mutation FLT3 qu'aucun traitement existant n'a réussi à traiter, progresse rapidement.
Hanmi Pharmaceutical Co. poursuit également le développement de médicaments anticancéreux ciblant les cellules T en identifiant des substances précliniques basées sur la technologie de la plate-forme d'IA avec Standigm, Inc. De plus, le potentiel de la combinaison de la substance candidate de médicament anticancéreux immunitaire oral (FLX475) de RAPT Therapeutics, Inc., avec Keytruda de Merck comme traitement du cancer gastrique, est en cours de recherche.
En même temps, une étude solide est menée impliquant l'anticorps bispécifique adopté de Phanes Therapeutics, Inc. Cette étude vise à accroître l'effet anticancéreux dans le microenvironnement de la tumeur (TME) grâce à une synergie avec le Pentambody, qui est également la technologie de la plate-forme d'anticorps bispécifiques développée par Beijing Hanmi Pharm. Co., Ltd.
En outre, une étude clinique sur l'anticorps bispécifique PD-1/HER2, en cours de développement avec Innovent Biologics, Inc., est actuellement en cours en Chine pour trouver une dose appropriée pour les patients atteints de tumeurs solides.
- S'efforcer de développer des traitements pour les maladies rares également
Hanmi Pharmaceutical Co., Ltd. prévoit également de se concentrer sur son rôle de société pharmaceutique pour un petit nombre de patients atteints de maladies rares, domaine dans lequel les besoins non satisfaits sont importants.
LAPS GLP-2 Analog, développé comme traitement du syndrome de l'intestin court, qui survient chez trois personnes pour un million, a confirmé son innocuité et son potentiel de dosage une fois par mois dans la première phase chez l'homme.
LAPS GLP-2 Analog a également été désigné comme médicament orphelin par la FDA et l'EMA en 2019 et a ensuite été désigné comme médicament pour les maladies pédiatriques rares (RPD) par la FDA en 2020. Il entrera en phase 2 d'essai clinique cette année.
En outre, le développement de l'hyperinsulinémie congénitale (CHI) et du syndrome de la maladie de stockage lysosomale (LSD) progresse de manière stable. En particulier, l'essai clinique de phase 2 sur le traitement de l'hyperinsulinémie congénitale a été approuvé récemment (le 9) par la FDA, et le développement s'accélère.
Se Chang Kwon, PDG de Hanmi Pharmaceutical Co., Ltd. a déclaré : « Hanmi Pharmaceutical Co., Ltd. accomplira la mission des entreprises pharmaceutiques, qui est de fournir de la valeur pour les vies humaines, en particulier pendant cette pandémie mondiale de COVID-19. Nous prévoyons de faire cela en poursuivant les projets pour faire face à la COVID-19, y compris le développement de diagnostics, de vaccins et de traitements. En outre, nous ferons de notre mieux pour répondre aux attentes en matière de R&D de Hanmi Pharmaceutical Co., Ltd. en obtenant l'approbation de la FDA pour les nouveaux médicaments ainsi qu'en accélérant les progrès cliniques pour augmenter la valeur des différents pipelines. »
Photo : https://mma.prnewswire.com/media/1421214/Hanmi_JPMorgan.jpg
Photo : https://mma.prnewswire.com/media/1421213/Hanmipipeline.jpg
Ces communiqués peuvent vous intéresser aussi
|
Communiqué envoyé le et diffusé par :



