Le dispositif LT-300 de LumiThera pour le traitement de la dégénérescence maculaire avancée de forme sèche obtient le marquage CE
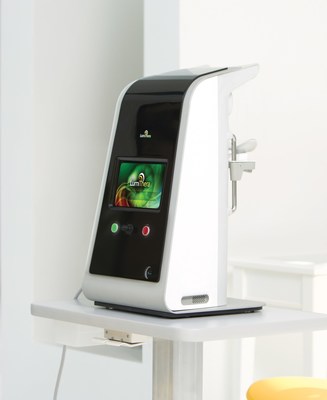
SEATTLE, 25 juin 2018 /PRNewswire/ -- LumiThera Inc., une société de dispositifs médicaux au stade commercial se consacrant au développement de thérapies par photobiomodulation (PBM) non invasives pour les maladies et les troubles oculaires, a annoncé que son dispositif LT-300 Light Delivery System (système d'émission de lumière), utilisé dans le traitement de la dégénérescence maculaire liée à l'âge de forme sèche (DMLA sèche), avait obtenu la certification du marquage CE pour l'Union européenne (UE).
Le marquage « CE » est l'abréviation de Conformité Européenne. Le marquage CE est une certification indiquant la conformité avec les directives liées à la santé, la sécurité et la protection de l'environnement pour des produits commercialisés au sein de l'Espace économique européen (EEE).
« Le marquage CE permet à LumiThera de commencer la commercialisation dans les 28 États membres de l'UE et coïncide avec le lancement de l'étude clinique LIGHTSITE II dans plusieurs sites européens dans les prochains mois, » a déclaré le docteur Clark Tedford, PDG de LumiThera. « Nous sommes ravis d'être capables de proposer une intervention précoce en stade clinique sûre et efficace pour les patients souffrant de DMLA sèche. »
« Il est très stimulant de voir se développer le traitement par PBM pour les patients atteints de DMLA sèche, » a dit Samuel Markowitz, docteur au département d'ophtalmologie et des sciences de la vision à l'Université de Toronto. « Ces patients disposent de peu d'options et perdre leur vision centrale est terriblement débilitant pour leur qualité de vie. Les études cliniques LIGHTSITE I précédentes ont démontré que la thérapie par PBM était la plus bénéfique chez les patients atteints de DMLA sèche à un stade précoce. Il a aussi été démontré que la répétition des traitements à des intervalles définis sera nécessaire pour maintenir les bénéfices cliniques. »
« La thérapie par PBM peut modifier la façon que nous avons de concevoir le traitement de la DMLA sèche, » affirme le docteur Robert Devenyi, ophtalmologiste en chef et directeur des services rétiniens, UHN, à l'université de Toronto. « Jusqu'à maintenant, nous attendions simplement et voyions les patients perdre la vue avec à notre disposition des options thérapeutiques limitées. Nous avons peut-être aujourd'hui un traitement qui peut cibler une amélioration des résultats de vision et réduire un élément clé de la pathologie. La prochaine étape consiste à confirmer les premiers résultats avec l'essai multicentre LIGHTSITE II et travailler avec la communauté médicale d'ophtalmologie pour établir les meilleures pratiques possible en matière de traitement. »
Rendez-vous sur le site web de la société à http://www.lumithera.com.
À propos de LumiThera Inc.
LumiThera est une société de dispositifs médicaux au stade commercial qui se consacre à traiter des personnes atteintes de troubles et de maladies oculaires comme la dégénérescence maculaire liée à l'âge de forme sèche, l'une des principales causes de cécité chez les adultes âgés de plus de 65 ans. La société est le chef de file dans l'utilisation de la photobiomodulation pour le traitement des maladies et troubles oculaires aigus et chroniques. La société s'investit dans le développement du LT-300 Light Delivery System (système d'émission de lumière) pour un usage en cabinet par des ophtalmologistes et d'autres spécialistes de la vue comme traitements médicaux non invasifs.
Un organisme notifié de l'UE a attribué l'autorisation d'utiliser le marquage CE pour ce dispositif comme requis pour un usage commercial uniquement au sein de l'Union européenne. Le LT-300 n'est pas encore approuvé pour son utilisation par la Food & Drug Administration (FDA, agence américaine des produits alimentaires et médicamenteux) aux États-Unis.
2018 LumiThera Inc., Tous droits réservés.
Photo - https://mma.prnewswire.com/media/709536/LumiThera_LT_300.jpg
Ces communiqués peuvent vous intéresser aussi
|
Communiqué envoyé le et diffusé par :



